Foto – Florian Gaertner/Photothek via Getty Images
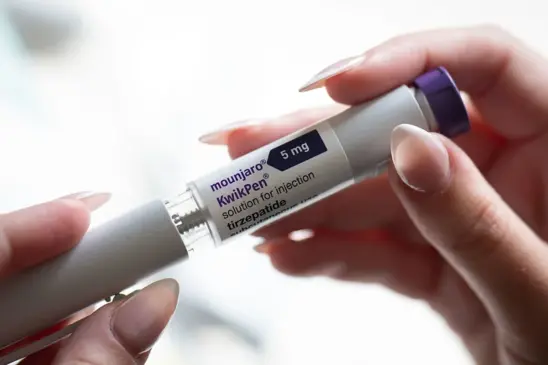
A Agência Europeia de Medicamentos (EMA) está investigando o medicamento para diabetes NOVOb.CO da Novo Nordisk, Ozempic, e o tratamento para perda de peso Saxenda, depois que o regulador de saúde da Islândia sinalizou três casos de pacientes pensando em suicídio ou automutilação.
Um comitê de segurança da EMA está analisando os eventos adversos levantados pela Agência de Medicamentos da Islândia, incluindo dois casos de pensamentos suicidas naqueles que usaram Ozempic, que contém o ingrediente ativo semaglutida, disse o regulador.
Outro paciente tomando Saxenda, o medicamento anterior e menos eficaz para perda de peso da Novo, que contém um ingrediente ativo diferente, relatou pensamentos de automutilação, disse a agência.Os dados de segurança não mostraram nenhuma “associação causal” entre os pensamentos suicidas ou de automutilação e os medicamento, acrescentou em um comunicado.
A Novo Nordisk disse que a segurança do paciente era a principal prioridade e tratava todos os relatórios sobre eventos adversos com muita seriedade. As ações da farmacêutica dinamarquesa caíram 1% nesta segunda-feira (10) após a notícia.A investigação da EMA se concentra em medicamentos que contêm semaglutida ou liraglutida.
O Wegovy, tratamento para obesidade da Novo, cuja demanda aumentou nos Estados Unidos, contém semaglutida, enquanto o Saxenda contém liraglutida. A revisão foi anunciada semanas depois que o regulador emitiu um sinal de segurança para o câncer de tireoide, um meio de monitorar efeitos potencialmente adversos, em vários produtos da Novo que contêm semaglutida.
Os pensamentos suicidas não estão listados como um efeito colateral na informação do produto da UE dos tratamentos.Nos Estados Unidos, no entanto, as instruções para Wegovy recomendam que os pacientes sejam monitorados quanto a pensamentos ou comportamentos suicidas.
De acordo com o Painel Público do Sistema de Relato de Eventos Adversos da Administração de Alimentos e Medicamentos dos EUA (FAERS), houve pelo menos 60 relatos de ideação suicida desde 2018 de pacientes em semaglutida ou de seus profissionais de saúde.Além disso, a FAERS recebeu pelo menos 70 desses relatórios de usuários de liraglutida ou de seus profissionais de saúde desde 2010.
As informações nos relatórios do FAERS não foram verificadas e a existência de um relatório não é prova de causalidade, diz o FDA. Os efeitos colaterais prejudicaram várias tentativas anteriores da indústria farmacêutica de desenvolver drogas lucrativas para perda de peso.
O SASY.PA Acomplia da Sanofi, que nunca obteve aprovação nos EUA, foi retirado da Europa em 2008 após ser associado a pensamentos suicidas. Acomplia foi concebido para modificar partes do sistema nervoso que regulam o apetite. Novos medicamentos para perda de peso, como o Wegovy, no entanto, regulam o apetite imitando um hormônio intestinal e não interferindo diretamente na química do cérebro. A EMA disse nesta segunda que consideraria se a revisão deveria ser estendida a outros medicamentos da mesma classe conhecidos como agonistas do receptor GLP-1.
Penny Ward, professora visitante de medicina farmacêutica no Kings College em Londres e especialista em monitoramento de segurança de medicamentos na UE, disse que não está claro por que o número muito pequeno de relatórios desencadeou a revisão da EMA, mas que isso pode resultar em uma ação séria como a retirada de um dos produtos do mercado.
“É mais provável que isso resulte em uma mudança na rotulagem, para que os prescritores sejam informados sobre esse possível efeito, para que possam alertar os pacientes e procurar pessoas que possam ser particularmente suscetíveis a esse tipo de problema”, disse Ward.
Fonte – CNN Brasil